Una investigación confirma el rol decisivo de la proteína reelina en la modulación de los procesos patológicos asociados al alzhéimer y a otras taupatías: acumulación de placas de amiloide, distribución aberrante de tau fosforilada, déficits sinápticos o pérdidas de memoria. Asimismo, este hallazgo abre nuevas perspectivas para diseñar futuras dianas terapéuticas, además de fármacos para la lucha contra estas patologías.
El estudio, que ha sido realizado por varios investigadores, entre ellos, Daniela Rossi, Eduardo Soriano y Lluís Pujadas, miembros de la Facultad de Biología de la Universidad de Barcelona (UB) y el Instituto de Neurociencias, así como otros científicos de CIBERNED y del Instituto de Investigación Vall d´Hebrón, asocian la pérdida de reelina que se ha asociado al aumento en la fosforilación de la proteína tau, vinculada a los microtúbulos y expresada en las neuronas, que se acaba depositando en forma de ovillos neurofibrilares, típicos en cuadros de Alzhéimer.
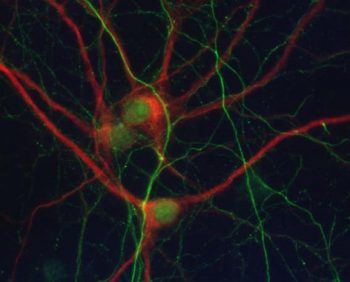
El estudio, que ha sido publicado en Progress in Neurobiology, describe nuevos datos moleculares sobre la ruta de señalización de la reelina y revela cómo esta proteína es capaz de revertir las principales afectaciones patológicas que el alzhéimer produce en diferentes funciones en modelos animales afectados por taupatías. Estos estudios in vitro confirman la capacidad de la reelina para modular la distribución anómala de neurofilamentos y de proteína tau en las dendritas, que se manifiesta en las primeras fases de estas neuropatologías.
Los resultados revelan que la sobreexpresión de reelina es capaz de modular los niveles de fosforilación de la proteína tau en modelos in vivo.
El alzhéimer es una patología neurodegenerativa caracterizada por la pérdida de conexiones entre neuronas y por la muerte neuronal. Se asocia principalmente a la formación de placas seniles (formadas por péptido β-amiloide, o Aβ) y la presencia de ovillos neurofibrilares (depósitos insolubles de proteína tau).



